Bệnh mảnh ghép chống chủ (Graft-versus-Host Disease – GvHD) là một trong những biến chứng nguy hiểm nhất sau ghép tế bào gốc tạo máu dị gen. Khi tế bào miễn dịch từ người cho không “chấp nhận” cơ thể người nhận, chúng có thể tấn công nhiều cơ quan quan trọng như da, gan và đường tiêu hóa. GvHD không chỉ ảnh hưởng đến chất lượng cuộc sống mà còn có thể đe dọa tính mạng nếu không được nhận diện và điều trị kịp thời.
Trong bài viết này, chúng ta sẽ cùng tìm hiểu sâu về cơ chế bệnh sinh, phân loại, triệu chứng và phương pháp điều trị bệnh mảnh ghép chống chủ, dựa trên các bằng chứng khoa học mới nhất và khuyến cáo của chuyên gia.
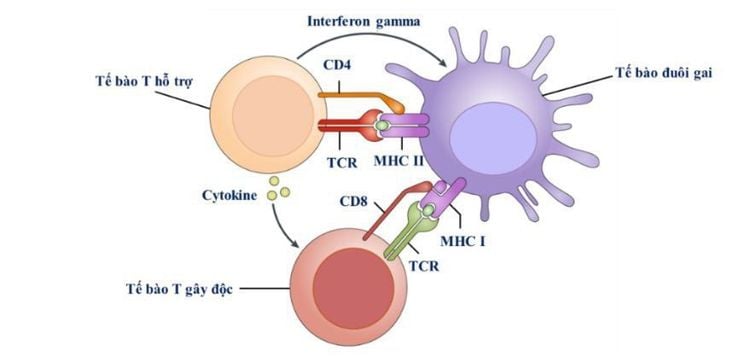
1. Bệnh mảnh ghép chống chủ là gì?
Bệnh mảnh ghép chống chủ (GvHD) là một phản ứng miễn dịch bất lợi xảy ra sau khi ghép tế bào gốc tạo máu từ người cho không đồng huyết thống hoặc không hoàn toàn phù hợp HLA. Thay vì giúp phục hồi hệ miễn dịch, các tế bào lympho T từ mảnh ghép lại nhận diện các mô của người nhận là “dị nguyên” và bắt đầu tấn công.
GvHD thường gặp trong các trường hợp:
- Ghép tế bào gốc tạo máu đồng loại (allogeneic HSCT).
- Không tương thích hoàn toàn HLA giữa người cho và người nhận.
- Không sử dụng hoặc sử dụng không đầy đủ thuốc ức chế miễn dịch sau ghép.
“Có thể xem GvHD như một cuộc chiến ngược chiều – khi hệ miễn dịch của người cho tấn công chính cơ thể người bệnh, thay vì bảo vệ họ khỏi tác nhân ngoại lai.” — GS. Dr. Steven Pavletic, Viện Ung thư Quốc gia Hoa Kỳ (NCI)
2. Cơ chế bệnh sinh của GvHD
GvHD phát sinh thông qua ba giai đoạn chính, tất cả đều liên quan đến sự kích hoạt và hoạt động của các tế bào T người cho:
2.1. Giai đoạn 1: Tổn thương mô đích do điều trị nền
Trước ghép, bệnh nhân thường trải qua hóa trị hoặc xạ trị liều cao để tiêu diệt tế bào ác tính và chuẩn bị cho mảnh ghép. Các liệu pháp này gây tổn thương mô, giải phóng cytokine như TNF-α, IL-1 và IL-6 – từ đó tạo môi trường “viêm” thuận lợi cho hoạt hóa miễn dịch.
2.2. Giai đoạn 2: Kích hoạt tế bào T từ mảnh ghép
Những tế bào T từ người cho nhận diện kháng nguyên HLA không tương thích ở người nhận. Dưới tác động của các tín hiệu viêm, chúng nhân lên và trở nên “hung hãn”, sẵn sàng tấn công các mô lạ.
2.3. Giai đoạn 3: Tổn thương mô do đáp ứng miễn dịch
Tế bào T hoạt hóa di chuyển đến các mô đích như da, gan và ruột. Chúng sản xuất các cytokine gây viêm (IFN-γ, TNF-α), hoạt hóa đại thực bào và gây chết tế bào theo cơ chế apoptosis, dẫn đến tổn thương mô diện rộng.
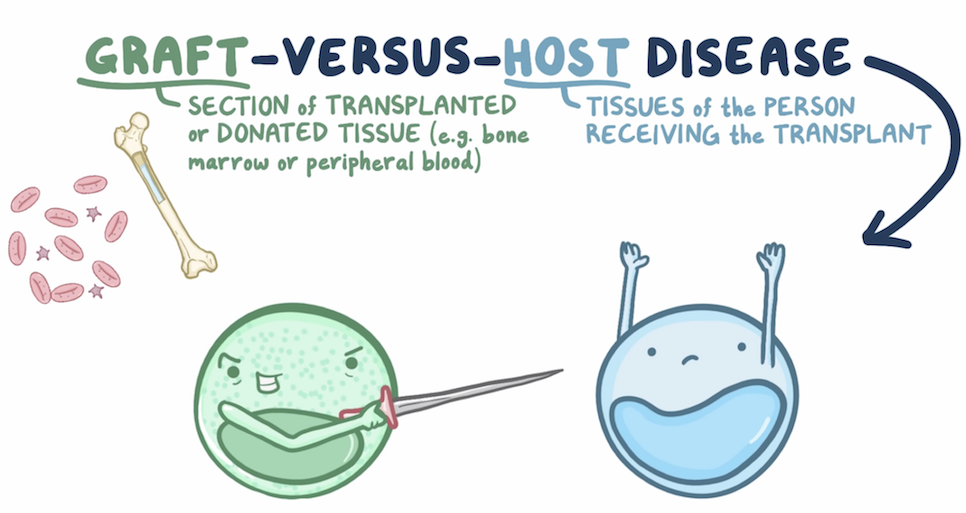
3. Phân loại GvHD: cấp tính và mạn tính
GvHD được chia thành 2 thể chính dựa trên thời gian xuất hiện và đặc điểm tổn thương cơ quan:
3.1. GvHD cấp tính (Acute GvHD)
- Xuất hiện trong vòng 100 ngày đầu sau ghép.
- Thường ảnh hưởng đến 3 cơ quan chính: da, gan, ống tiêu hóa.
- Được phân độ từ I đến IV dựa trên mức độ tổn thương mô.
| Độ GvHD | Da | Gan (bilirubin) | Ống tiêu hóa |
|---|---|---|---|
| I | <25% diện tích | <2 mg/dL | Tiêu chảy <500 ml/ngày |
| II | 25–50% | 2–3 mg/dL | 500–1000 ml/ngày |
| III | >50% + bóng nước | 3–6 mg/dL | 1000–1500 ml/ngày |
| IV | Bóng nước lan rộng, hoại tử | >6 mg/dL | >1500 ml/ngày hoặc đau bụng dữ dội |
3.2. GvHD mạn tính (Chronic GvHD)
- Thường xuất hiện sau 100 ngày hoặc muộn hơn sau ghép.
- Có thể ảnh hưởng đến nhiều cơ quan: da, mắt, miệng, gan, phổi, cơ – khớp, đường sinh dục.
- Biểu hiện giống các bệnh tự miễn như xơ cứng bì, lupus ban đỏ hệ thống.
4. Triệu chứng lâm sàng của GvHD
4.1. Triệu chứng GvHD cấp tính
GvHD cấp thường biểu hiện rõ rệt, đặc trưng ở 3 cơ quan sau:
- Da: Ban đỏ lan tỏa, thường bắt đầu ở lòng bàn tay, bàn chân, sau đó lan rộng khắp cơ thể. Trường hợp nặng có thể nổi bọng nước, bong tróc như phỏng da.
- Gan: Tăng bilirubin máu, vàng da, mệt mỏi, chán ăn.
- Tiêu hóa: Tiêu chảy không kiểm soát, buồn nôn, đau bụng dữ dội, xuất huyết đường ruột.
4.2. Triệu chứng GvHD mạn tính
GvHD mạn diễn tiến âm thầm hơn, nhưng lại gây tổn thương sâu rộng:
- Da: Khô, xơ hóa, mất độ đàn hồi, sạm da.
- Mắt: Khô mắt, viêm kết mạc, đau rát.
- Miệng: Loét miệng, khô miệng, khó ăn.
- Phổi: Khó thở, xơ hóa phổi, giảm khả năng hô hấp.
- Khớp: Co rút cơ, giới hạn vận động.
Những triệu chứng này ảnh hưởng lớn đến sinh hoạt, ăn uống, tâm lý và chất lượng sống người bệnh, đòi hỏi quản lý y tế lâu dài.
5. Các yếu tố nguy cơ của GvHD
Không phải ai trải qua ghép tế bào gốc tạo máu cũng sẽ mắc GvHD, tuy nhiên một số yếu tố làm tăng nguy cơ mắc bệnh này rõ rệt. Việc nhận diện các yếu tố nguy cơ giúp bác sĩ có chiến lược dự phòng và theo dõi sát hơn sau ghép.
- Không tương thích HLA: Ghép giữa người cho và người nhận không hoàn toàn phù hợp HLA là yếu tố nguy cơ cao nhất.
- Ghép từ người không cùng huyết thống: Người cho không phải người thân trong gia đình có nguy cơ gây GvHD cao hơn.
- Tuổi người nhận cao: Người lớn tuổi thường có hệ miễn dịch yếu, dễ tổn thương khi bị tế bào T tấn công.
- Lượng tế bào T trong mảnh ghép cao: Tế bào T nhiều làm tăng khả năng tấn công mô cơ thể người nhận.
- Không dùng hoặc ngưng sớm thuốc ức chế miễn dịch: Thiếu kiểm soát miễn dịch sau ghép là điều kiện thuận lợi để GvHD bùng phát.
6. Các phương pháp chẩn đoán GvHD
Chẩn đoán GvHD dựa vào kết hợp triệu chứng lâm sàng và các xét nghiệm hỗ trợ. Điều quan trọng là loại trừ các nguyên nhân khác có triệu chứng tương tự như nhiễm trùng hoặc độc tính thuốc.
- Lâm sàng: Dựa vào thời điểm xuất hiện triệu chứng sau ghép và cơ quan bị ảnh hưởng.
- Sinh thiết mô: Da, gan, niêm mạc ruột – giúp xác định tổn thương đặc trưng của GvHD như hoại tử tế bào biểu mô, thâm nhiễm lympho T.
- Xét nghiệm máu: Tăng men gan (ALT, AST, bilirubin), giảm albumin, CRP tăng.
- Nội soi tiêu hóa: Quan sát viêm niêm mạc, loét, chảy máu ruột – hỗ trợ xác định GvHD đường tiêu hóa.
7. Các phương pháp điều trị GvHD hiện nay
7.1. Điều trị GvHD cấp tính
Đây là trường hợp cần điều trị sớm và tích cực nhằm kiểm soát phản ứng miễn dịch quá mức và hạn chế tổn thương mô lan rộng.
- Thuốc Corticoid: Prednisolone liều cao là lựa chọn đầu tay. Khoảng 50% bệnh nhân đáp ứng tốt.
- Ức chế miễn dịch: Tacrolimus hoặc Cyclosporin thường được phối hợp để kiểm soát lâu dài.
- Kháng thể đơn dòng: Anti-TNF alpha (Infliximab), Basiliximab được dùng khi kháng Corticoid.
- Chăm sóc hỗ trợ: Truyền dịch, kiểm soát tiêu chảy, dinh dưỡng tĩnh mạch nếu cần thiết.
7.2. Điều trị GvHD mạn tính
Điều trị GvHD mạn thường kéo dài và cá thể hóa theo mức độ tổn thương cơ quan.
- Corticoid liều thấp: Duy trì lâu dài để kiểm soát triệu chứng.
- Ức chế miễn dịch bổ sung: Mycophenolate mofetil, Sirolimus giúp giảm tiến triển xơ hóa.
- Điều trị chuyên biệt: Tra nước mắt nhân tạo, thuốc dưỡng ẩm da, liệu pháp hô hấp nếu có tổn thương phổi.
8. Phòng ngừa bệnh mảnh ghép chống chủ
Phòng ngừa GvHD là chiến lược then chốt để cải thiện kết quả sau ghép. Một số biện pháp hiệu quả bao gồm:
- Chọn người cho phù hợp HLA tối đa: Sàng lọc kỹ HLA giữa người cho và nhận trước khi ghép.
- Dự phòng miễn dịch: Sử dụng thuốc ức chế miễn dịch ngay sau ghép (prophylactic immunosuppressants).
- Loại bỏ tế bào T: Tách tế bào T khỏi mảnh ghép trước khi truyền để giảm nguy cơ phản ứng miễn dịch.
- Theo dõi sau ghép sát sao: Đo men gan, công thức máu, khám da định kỳ để phát hiện sớm tổn thương.
9. Tiên lượng và biến chứng lâu dài
Tiên lượng bệnh GvHD phụ thuộc vào mức độ nghiêm trọng, thời điểm phát hiện và khả năng đáp ứng điều trị. Một số biến chứng lâu dài có thể bao gồm:
- Xơ hóa da và cơ quan nội tạng: Da dày, phổi xơ, rối loạn hô hấp mạn tính.
- Nhiễm trùng tái diễn: Do ức chế miễn dịch kéo dài.
- Rối loạn nội tiết – chuyển hóa: Loãng xương, tiểu đường, tăng huyết áp.
- Suy giảm chất lượng sống: Mệt mỏi kéo dài, khó vận động, trầm cảm.
10. Khi nào cần đến gặp bác sĩ?
Người bệnh sau ghép tế bào gốc cần đến ngay cơ sở y tế khi có các dấu hiệu nghi ngờ GvHD như:
- Ban đỏ, ngứa, rộp da bất thường.
- Tiêu chảy nhiều lần/ngày, phân có máu, đau bụng dữ dội.
- Vàng da, nước tiểu sậm màu, buồn nôn dai dẳng.
- Khó thở, đau ngực, sụt cân nhanh không rõ nguyên nhân.
11. Tổng kết
Bệnh mảnh ghép chống chủ là biến chứng miễn dịch nghiêm trọng sau ghép tế bào gốc tạo máu, có thể gây tử vong nếu không được phát hiện và điều trị kịp thời. Hiểu rõ cơ chế bệnh, nhận diện triệu chứng sớm và áp dụng các biện pháp điều trị, phòng ngừa phù hợp là chìa khóa để cải thiện tiên lượng và chất lượng sống cho bệnh nhân.
Lưu ý: Việc theo dõi sát sao sau ghép, tuân thủ điều trị và trao đổi thường xuyên với bác sĩ chuyên khoa huyết học – ghép tủy sẽ giúp người bệnh chủ động trong việc phòng ngừa GvHD.
12. Câu hỏi thường gặp (FAQ)
GvHD có thể chữa khỏi hoàn toàn không?
GvHD có thể kiểm soát tốt nếu được phát hiện sớm và điều trị đúng cách. Tuy nhiên, GvHD mạn có thể để lại di chứng lâu dài.
GvHD chỉ xảy ra sau ghép tủy xương?
Không. GvHD có thể xảy ra sau bất kỳ loại ghép tế bào gốc tạo máu dị gen nào, bao gồm ghép từ máu ngoại vi và máu cuống rốn.
Tôi có thể phòng GvHD bằng chế độ ăn không?
Chế độ ăn là yếu tố hỗ trợ, nhưng phòng ngừa GvHD chủ yếu dựa vào kiểm soát miễn dịch, chọn người cho phù hợp HLA và theo dõi sát sau ghép.
GvHD có di truyền không?
Không. GvHD không phải bệnh di truyền mà là phản ứng miễn dịch sau ghép tế bào gốc từ người khác.
Hành động tiếp theo:
Nếu bạn hoặc người thân đang chuẩn bị ghép tế bào gốc hoặc có dấu hiệu nghi ngờ GvHD, hãy liên hệ ngay với bác sĩ chuyên khoa huyết học để được tư vấn cá nhân hóa và điều trị kịp thời.
Đọc thêm các bài viết chuyên sâu về ghép tế bào gốc, rối loạn huyết học và bệnh tự miễn tại ThuVienBenh.com.
📝Nguồn tài liệu: Chọn lọc từ nhiều nguồn y tế uy tín
🔎Lưu ý: Bài viết chỉ nhằm mục đích cung cấp thông tin tổng quan. Vui lòng tham khảo ý kiến của Bác sĩ, Dược sĩ hoặc chuyên gia y tế để nhận được hướng dẫn phù hợp với tình trạng sức khỏe của bạn.
