Bệnh bạch cầu cấp dòng tủy (Acute Myeloid Leukemia – AML) là một bệnh lý ác tính huyết học nguy hiểm, diễn tiến nhanh và cần điều trị tích cực. Trong số các thể bệnh AML, AML liên quan đến điều trị (treatment-related AML – t-AML) là một dạng đặc biệt, phát sinh như một biến chứng thứ phát sau quá trình điều trị các loại ung thư khác. Đây là vấn đề ngày càng được quan tâm trong thực hành lâm sàng bởi xu hướng điều trị ung thư hiện đại ngày càng kéo dài thời gian sống của người bệnh, từ đó làm tăng nguy cơ xuất hiện t-AML. Bài viết này sẽ giúp bạn đọc hiểu rõ về nguyên nhân, cơ chế, biểu hiện và cách chẩn đoán bệnh lý đặc biệt này.
Nguyên nhân và cơ chế bệnh sinh của AML liên quan đến điều trị
1. Hóa trị – con dao hai lưỡi
Hóa trị là phương pháp điều trị ung thư phổ biến, có khả năng tiêu diệt tế bào ung thư hiệu quả. Tuy nhiên, chính các thuốc hóa trị cũng có thể gây tổn thương DNA của tế bào gốc tạo máu trong tủy xương, dẫn đến đột biến gen và hình thành t-AML sau nhiều năm.
Các nhóm thuốc thường liên quan đến nguy cơ cao gây t-AML gồm:
- Alkylating agents (cyclophosphamide, busulfan, melphalan…): thường gây đột biến mất nhiễm sắc thể 5 và 7, kèm theo giai đoạn trung gian là hội chứng rối loạn sinh tủy (MDS), thời gian tiềm ẩn khoảng 5–7 năm sau điều trị.
- Topoisomerase II inhibitors (etoposide, doxorubicin, mitoxantrone…): thường gây chuyển đoạn tại gen MLL (11q23), khởi phát nhanh hơn, sau khoảng 1–3 năm điều trị, không qua giai đoạn MDS.
2. Tác động của xạ trị
Bức xạ ion hóa có thể làm tổn thương DNA tế bào tạo máu, đặc biệt khi chiếu vào vùng xương chậu, cột sống hoặc ngực – nơi chứa nhiều tủy xương. Tỷ lệ t-AML tăng lên ở bệnh nhân ung thư vú, u lympho Hodgkin, ung thư phổi… đã từng xạ trị với liều cao hoặc diện rộng.
3. Tác nhân phối hợp và yếu tố cá nhân
Nguy cơ cao hơn xuất hiện ở các bệnh nhân điều trị phối hợp hóa trị – xạ trị. Ngoài ra, một số yếu tố cá nhân cũng góp phần vào cơ chế bệnh sinh:
- Tiền sử rối loạn sinh tủy
- Đột biến gen di truyền như TP53, RUNX1, ASXL1
- Tuổi cao, hệ miễn dịch suy yếu

Biểu hiện lâm sàng của AML liên quan đến điều trị
1. Triệu chứng thường gặp
Tương tự các thể AML khác, t-AML khởi phát với biểu hiện giảm ba dòng tế bào máu ngoại vi do tủy xương bị lấn át bởi các tế bào blast:
- Thiếu máu: mệt mỏi, chóng mặt, da xanh xao, giảm khả năng gắng sức
- Giảm bạch cầu: dễ nhiễm trùng, sốt kéo dài, viêm phổi, loét miệng
- Giảm tiểu cầu: xuất huyết dưới da, chảy máu mũi, rong kinh
Tuy nhiên, do bệnh xuất hiện trên nền bệnh nhân đã từng điều trị ung thư, nên các triệu chứng đôi khi bị che lấp hoặc nhầm lẫn với biến chứng điều trị cũ.
2. Dấu hiệu cảnh báo nguy cơ cao
Các trường hợp sau cần được tầm soát t-AML sớm nếu có dấu hiệu bất thường:
- Bệnh nhân ung thư vú, lympho, phổi… đã điều trị ≥ 1 năm trước
- Tiền sử hóa trị với etoposide hoặc cyclophosphamide
- Xuất hiện bất thường huyết học kéo dài như thiếu máu không rõ nguyên nhân, giảm tiểu cầu dai dẳng
3. Các chỉ số cận lâm sàng đặc trưng
Xét nghiệm máu cho thấy:
- Bạch cầu tăng hoặc giảm, nhưng tế bào blast chiếm ≥ 20%
- Giảm hồng cầu và tiểu cầu
- Tủy đồ: tủy xương giàu tế bào non dòng tủy, bất sản các dòng tế bào bình thường
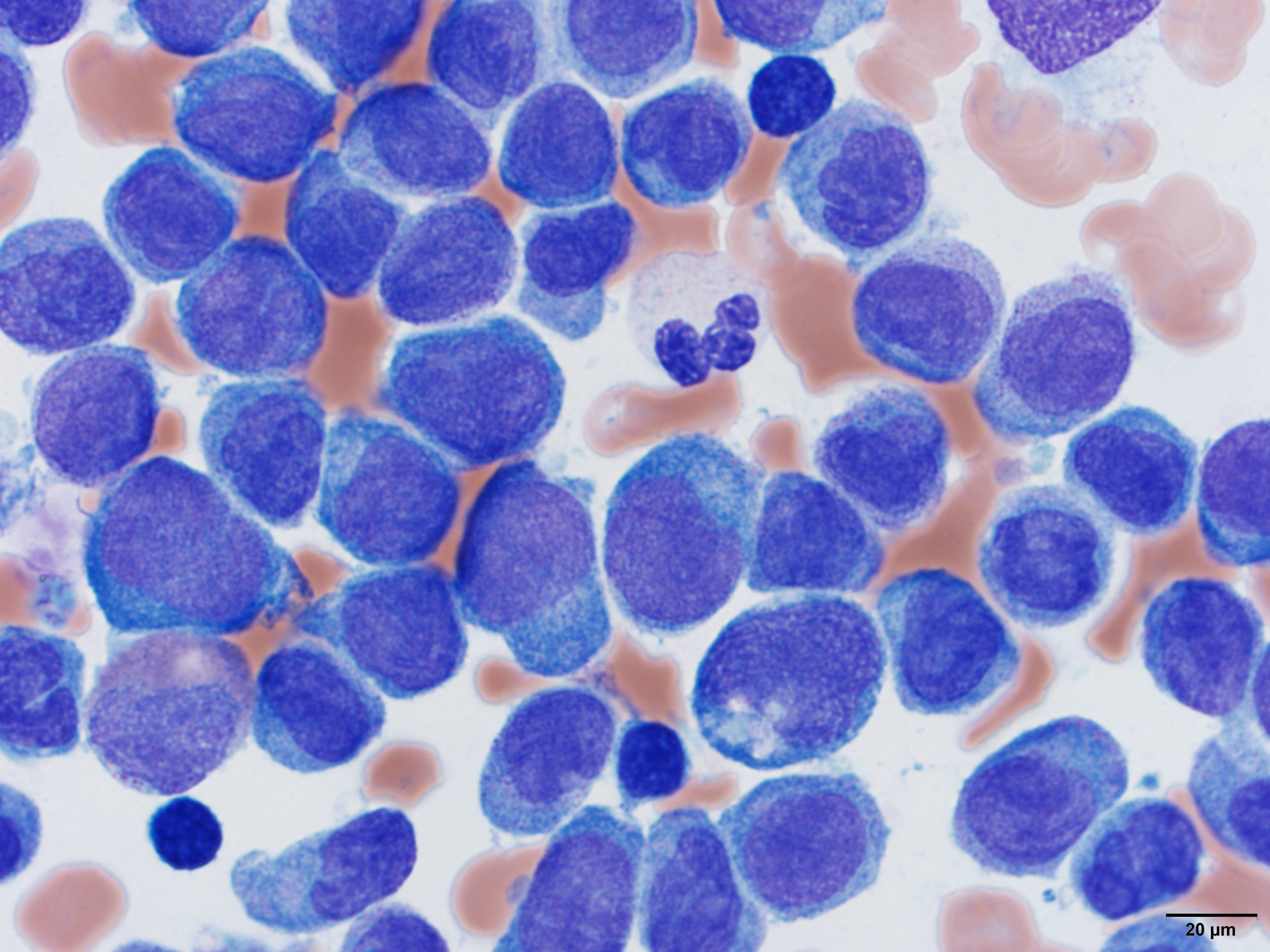
Đặc điểm di truyền học của AML liên quan đến điều trị
Điểm khác biệt chính của t-AML so với AML nguyên phát nằm ở đặc điểm di truyền học. Theo nghiên cứu của Viện Ung thư Quốc gia Hoa Kỳ (NCI), hơn 70% ca t-AML có bất thường gen sau:
1. Bất thường nhiễm sắc thể đặc trưng
- Mất nhiễm sắc thể 5 hoặc 7: liên quan đến nhóm thuốc alkylating
- Chuyển đoạn 11q23 (MLL gene): do topoisomerase II inhibitor
- Đảo đoạn inv(16) hoặc chuyển đoạn t(15;17) hiếm gặp hơn
2. Đột biến gen mang tiên lượng xấu
- TP53: gặp ở >30% trường hợp, tiên lượng rất xấu
- RUNX1, ASXL1, SRSF2: liên quan đến kháng điều trị
3. Vai trò của giải trình tự gen thế hệ mới (NGS)
Hiện nay, kỹ thuật NGS giúp phát hiện chính xác các đột biến gen ngay cả ở giai đoạn rất sớm, từ đó giúp tiên lượng và định hướng điều trị phù hợp.
Chiến lược điều trị AML liên quan đến điều trị
1. Hóa trị cảm ứng
Liệu pháp hóa trị cảm ứng là bước đầu tiên trong điều trị AML, nhằm loại bỏ tối đa các tế bào bạch cầu ác tính. Tuy nhiên, ở bệnh nhân t-AML, do thường cao tuổi, sức khỏe nền yếu và mang các đột biến tiên lượng xấu nên hóa trị chuẩn “7+3” (cytarabine + anthracycline) có thể không phải là lựa chọn phù hợp cho tất cả.
Hiện nay, phác đồ kết hợp venetoclax và azacitidine hoặc decitabine (thuốc ức chế methyl hóa DNA) được xem là hướng đi mới cho các bệnh nhân không thể chịu đựng hóa trị liều cao, với tỷ lệ đáp ứng đạt đến 60–70% trong nhiều nghiên cứu lâm sàng.
2. Ghép tế bào gốc tạo máu (HSCT)
Ghép tế bào gốc dị gen là phương pháp duy nhất hiện nay có khả năng chữa khỏi t-AML nếu thực hiện thành công. Tuy nhiên, tỷ lệ biến chứng sau ghép, nguy cơ tử vong do điều trị cao và nguy cơ tái phát sau ghép cũng rất đáng kể.
- Đối tượng phù hợp: dưới 65 tuổi, có đáp ứng hoàn toàn sau hóa trị, tìm được người cho phù hợp HLA.
- Thời điểm ghép: càng sớm càng tốt sau khi đạt lui bệnh hoàn toàn lần đầu.
Theo nghiên cứu SEER (Hoa Kỳ), tỷ lệ sống 5 năm của bệnh nhân t-AML sau ghép đạt khoảng 30–40%.
3. Điều trị nhắm trúng đích và liệu pháp mới
Ngoài venetoclax, các thuốc nhắm trúng đích mới đang được ứng dụng trong điều trị t-AML có đột biến đặc hiệu:
- Midostaurin, gilteritinib: dùng cho bệnh nhân có đột biến FLT3
- Enasidenib: dành cho t-AML mang đột biến IDH2
- Ivosidenib: dành cho t-AML có đột biến IDH1
Các thử nghiệm lâm sàng cũng đang đánh giá hiệu quả của liệu pháp miễn dịch, kháng thể hai đặc hiệu (bi-specific T-cell engagers – BiTE) và CAR-T trong tương lai.
Tiên lượng sống và biến số ảnh hưởng
1. Tỷ lệ sống
So với AML nguyên phát, t-AML có tiên lượng xấu hơn rõ rệt. Theo một phân tích từ Viện Ung thư Quốc gia Hoa Kỳ:
- Tỷ lệ sống sót sau 1 năm: khoảng 30%
- Tỷ lệ sống sau 5 năm: dưới 10–20%
Tỷ lệ này cải thiện rõ ở nhóm bệnh nhân được ghép tế bào gốc hoặc đáp ứng với venetoclax.
2. Yếu tố ảnh hưởng tiên lượng
| Yếu tố | Ảnh hưởng tiên lượng |
|---|---|
| Tuổi cao (>60) | Tiên lượng xấu hơn |
| Đột biến TP53 | Kháng điều trị, tỷ lệ tái phát cao |
| Không thể ghép tế bào gốc | Hạn chế cơ hội điều trị triệt để |
| Chẩn đoán muộn | Bệnh tiến triển nhanh, đáp ứng thấp |
Phòng ngừa và theo dõi người bệnh nguy cơ cao
1. Phòng ngừa từ đầu
Hiện chưa có biện pháp ngăn ngừa tuyệt đối t-AML. Tuy nhiên, việc cá nhân hóa điều trị ung thư, hạn chế sử dụng kéo dài các thuốc hóa trị độc tế bào, và cân nhắc liều xạ trị là các bước quan trọng giúp giảm nguy cơ.
2. Theo dõi định kỳ
Với những bệnh nhân đã từng hóa trị/xạ trị, đặc biệt trong vòng 1–10 năm, cần:
- Xét nghiệm công thức máu định kỳ mỗi 3–6 tháng
- Kiểm tra tủy đồ nếu có bất thường huyết học kéo dài
- Tư vấn di truyền nếu phát hiện các đột biến nguy cơ
Kết luận
AML liên quan đến điều trị là một thách thức lớn trong chuyên ngành huyết học – ung thư. Việc phát hiện sớm, hiểu rõ nguyên nhân, cơ chế bệnh sinh và áp dụng các chiến lược điều trị cá thể hóa là chìa khóa giúp cải thiện tiên lượng cho người bệnh. Trong bối cảnh ung thư ngày càng phổ biến, việc theo dõi lâu dài và tầm soát định kỳ ở nhóm nguy cơ cao là hết sức cần thiết.
Gọi hành động
Nếu bạn hoặc người thân từng điều trị ung thư và gặp phải các triệu chứng bất thường như mệt mỏi kéo dài, chảy máu bất thường hay sốt không rõ nguyên nhân, hãy liên hệ ngay với bác sĩ huyết học để được tư vấn và xét nghiệm tủy kịp thời.
Câu hỏi thường gặp (FAQ)
1. AML liên quan điều trị có thể chữa khỏi không?
Có, nhưng tỷ lệ chữa khỏi thấp hơn so với AML nguyên phát. Phẫu thuật ghép tế bào gốc và đáp ứng với thuốc trúng đích là hai yếu tố quan trọng quyết định khả năng sống sót lâu dài.
2. Sau bao lâu điều trị ung thư thì có thể mắc AML liên quan điều trị?
Thông thường từ 1 đến 10 năm sau khi kết thúc hóa trị hoặc xạ trị, tùy loại thuốc và phương pháp điều trị trước đó.
3. Có nên làm tầm soát AML sau điều trị ung thư?
Với những bệnh nhân điều trị bằng thuốc gây độc tủy, đặc biệt nhóm alkylating hoặc topoisomerase II inhibitors, nên tầm soát công thức máu và chức năng tủy định kỳ 6 tháng – 1 năm.
4. AML liên quan điều trị có di truyền không?
Không di truyền, nhưng nguy cơ cao hơn ở người mang sẵn đột biến gen ung thư trong dòng tế bào gốc.
5. Người cao tuổi có thể điều trị t-AML không?
Hoàn toàn có thể. Các liệu pháp nhẹ nhàng hơn như venetoclax kết hợp azacitidine hiện đang là lựa chọn hiệu quả và dung nạp tốt ở nhóm này.
📝Nguồn tài liệu: Chọn lọc từ nhiều nguồn y tế uy tín
🔎Lưu ý: Bài viết chỉ nhằm mục đích cung cấp thông tin tổng quan. Vui lòng tham khảo ý kiến của Bác sĩ, Dược sĩ hoặc chuyên gia y tế để nhận được hướng dẫn phù hợp với tình trạng sức khỏe của bạn.
